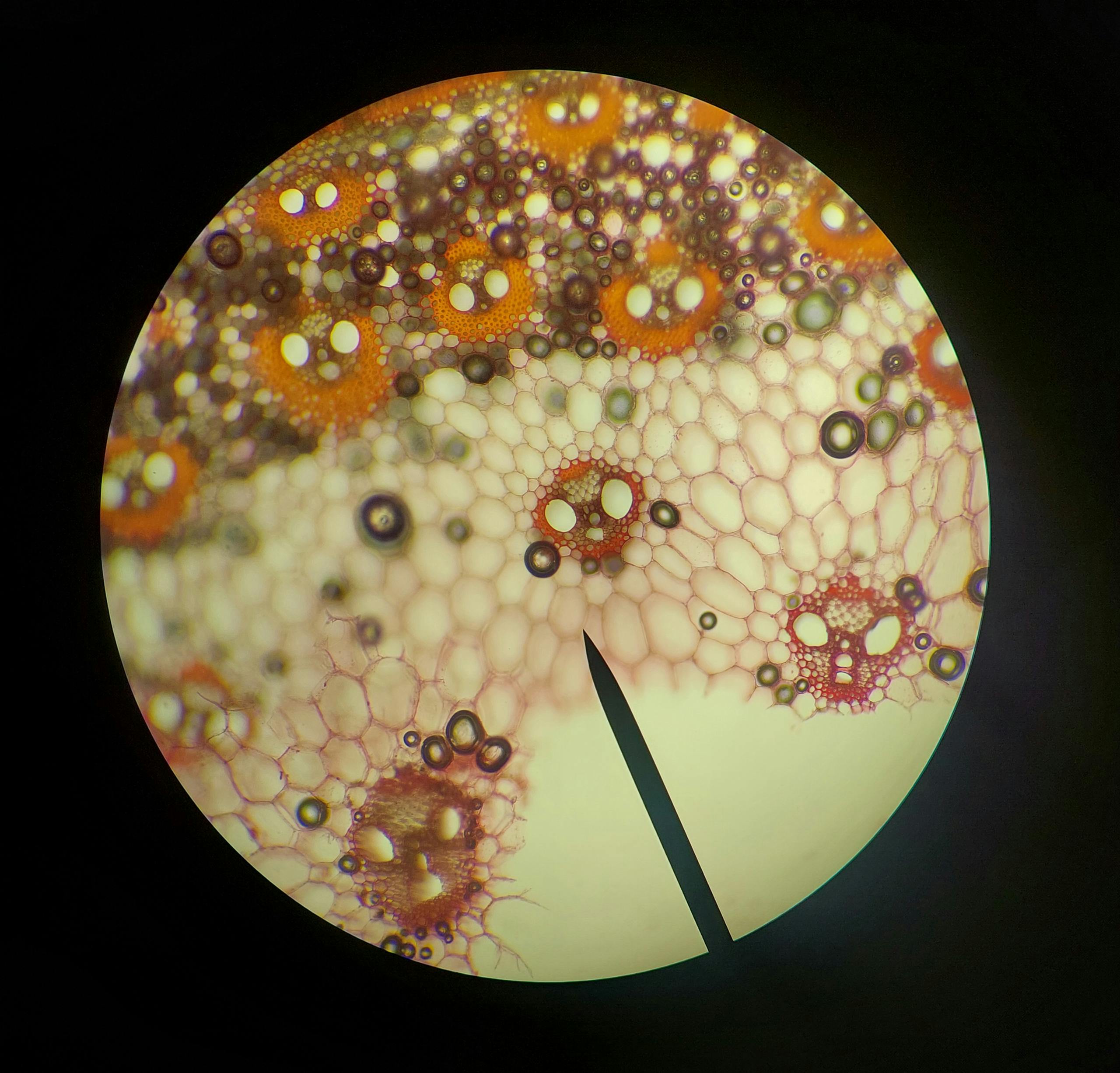
Macierz zewnątrzkomórkowa (ECM) w rękach osteopaty
Macierz zewnątrzkomórkowa (z ang. extracellular matrix; w skrócie ECM) to złożona sieć makrocząsteczek znajdująca się na zewnątrz komórek, w której te dryfują. ECM zapewnia tkankom wsparcie strukturalne i biochemiczne. Jest to synonim powięzi. Przeczytaj i zobacz w jaki sposób osteopatia opiera się o mechanizm fizjologiczny macierzy zewnątrzkomórkowej.
Skład macierzy zewnątrzkomórkowej (ECM)
- Włókna strukturalne
- kolagen wytrzymały na rozciąganie
- elastyna nadająca sprężystości – pozwala na przywrócenie do pierwotnego kształtu po rozciąganiu
- Substancja podstawowa
- proteoglikany i glikozaminoklikany (np. kwas hialuronowy) – posiadają zdolność wiązania wody, dlatego nadają macierzy żelową strukturą i odporność na ściskanie
- glikoproteiny adhezyjne – łączą macierz z komórkami i samą macierz ze sobą, niczym klej
- Płyn międzykomórkowy (śródmiąższowy)
- głównie woda
- dodatkowo jony (m.in. sodu, potasu), aminokwasy, glukoza, kwasy tłuszczowe, mleczany, mocznik, dwutlenek węgla, hormony, cytokiny, czynniki wzrostu oraz niewielka ilość białek
Dlaczego osteopata czuje sztywność powięziową?
Zarówno płyn międzykomórkowy, jak i cała macierz zewnątrzkomórkowa zagęszczają się w stanie zapalnym, jak i w wyniku nagromadzenia metabolitów (zmiana pH). Mediatory stanu zapalnego (m.in. histamina, bradykinina, leukotrieny) powodują rozszerzenie naczyń krwionośnych i, co najważniejsze, zwiększają przepuszczalność ich śródbłonka. Przez te „nieszczelne” naczynia do przestrzeni międzykomórkowej zaczynają masowo przenikać białka osocza o dużej masie cząsteczkowej, które normalnie pozostają w krwiobiegu – kluczowe w tym procesie jest białko (fibrynogen).
Stan zapalny, ECM, palpacyjna sztywność tkankowa dla osteoapaty
Nagromadzenie białek w płynie międzykomórkowym podnosi jego ciśnienie onkotyczne, co działa jak magnes na wodę, który wyciaga jeszcze więcej płynu z naczyń do tkanki powodując obrzęk.
Ciśnienie onkotyczne to rodzaj ciśnienia osmotycznego (ciśnienie, którym należy działać na roztwór, aby powstrzymać przepływ rozpuszczalnika, przez półprzepuszczalną membranę, która rozdziela roztwory o różnym stężeniu) wywieranego przez roztwór koloidalny (mieszanina >2 składników) białek obecnych w osoczu krwi. Zawartość białek w osoczu jest wyższa od tej w płynie międzykomórkowym, toteż ciśnienie onkotyczne krwi w naczyniach krwionośnych jest wyższe od ciśnienia osmotycznego w obrębie płynów tkankowych. Taki mechanizm fizjologiczny zapobiega przesiękom wody z elektrolitami z osocza krwi do tkanek.
W środowisku zapalnym fibrynogen zostaje przekształcony w fibrynę. Włókna fibryny tworzą w przestrzeni międzykomórkowej twójwymiarową, lepką sieć. Stan zapalny wpływa również na wielkocząsteczkowe proteoglikany w ECM (np. kwas hialurowany), które zaczynają wiązać jeszcze więcej wody, dodatkowo przyczyniając się do zmiany konsystencji na bardziej żelową.
Efekt końcowy stanu zapalnego w macierzy zewnątrzkomórkowej
Płyn międzykomórkowy i cała macierz ECM zmieniają się z płynnej substancji w gęsty, lepki żel. W jakim celu? Dla izolacji obszaru zapalnego, aby uniemożliwić rozprzestrzenianie się potencjalnych patogenów i toksyn oraz jednocześnie wyizolować patogeny w jednym miejscu, aby ułatwić proces fagocytozy (walki odpornościowej). Również w celu stworzenia rusztowania dla nowych komórek (fibroblastów, komórek odpornościowych) i procesów naprawczych, regeneracyjnych tkanek.
Osteopatia macierzy zewnątrzkomórkowej, powięzi
Leczenie osteopatyczne oparte jest o wykrywanie i uwalnianie dysfunkcji somatycznych, które stanowią patologie mechaniki tkanek, dalej zaburzając ich funkcję lub prowadząc do uszkodzeń. Nie chodzi jednak bezpośrednio o ruchomość tkanki, a bardziej o jej odżywienie i samo naprawę. Dobrze odżywiona tkanka (zbudowana z komórek pływających w ECM) funkcjonuje w stopniu nie ograniczającym jej fizjologii biomechanicznej, co pozwala na swobodny ruch ciała.
Źródła:
- Schleip, R., Findley, T. W., Chaitow, L., & Huijing, P. A. (Eds.). (2012). Fascia: The Tensional Network of the Human Body: The science and clinical applications in manual and movement therapy. Elsevier Health Sciences.
- Theocharis, A. D., Skandalis, S. S., Gialeli, C., & Karamanos, N. K. (2016). Extracellular matrix structure. Advanced drug delivery reviews, 97, 4-27.
- Wiig, H., Swartz, M. A., & Aukland, K. (2012). The interstitial fluid: a dynamic player in the local regulation of tissue functions. Physiological Reviews, 92(3), 1275-1311.
- Frantz, C., Stewart, K. M., & Weaver, V. M. (2010). The extracellular matrix: a scaffold for tissue repair. Science, 330(6008), 1186-1188.
- Sorokin, L. (2010). The impact of the extracellular matrix on inflammation. Nature Reviews Immunology, 10(10), 712–723.
- Davalos, D., & Akassoglou, K. (2012). Fibrinogen as a key regulator of inflammation in disease. Seminars in immunopathology, 34(1), 43–62.
- Lindinger, M. I., & Sjøgaard, G. (1991). Potassium and lactate shifts in exercising human skeletal muscle. Sports Medicine, 11(6), 360-377.
- Stecco, C., Stern, R., Porzionato, A., Macchi, V., Masiero, S., Stecco, A., & De Caro, R. (2011). Hyaluronan within the subcutaneous tissue of the trunk: a morphological study. Surgical and Radiologic Anatomy, 33(10), 891–897.
- Stecco, C., Macchi, V., Porzionato, A., Day, J. A., & De Caro, R. (2010). The fascia: the forgotten structure. Italian Journal of Anatomy and Embryology, 115(3), 127-138.
- Schleip, R. (2003). Fascial plasticity–a new neurobiological explanation: Part 1. Journal of Bodywork and Movement Therapies, 7(1), 11-19.
- Langevin, H. M., & Huijing, P. A. (2009). The architectural basis of fascia-related pain. Journal of Bodywork and Movement Therapies, 13(3), 205-216.
- Schleip, R., Jäger, H., & Klingler, W. (2012). What is ‘fascia’? A review of different nomenclatures. Journal of Bodywork and Movement Therapies, 16(4), 496-502.
- Reed, R. K., & Rubin, K. (2010). Transcapillary exchange: role of the interstitium, lymphatic system, and interstitium. In Comprehensive Physiology. John Wiley & Sons, Inc.
- Grinnell, F. (2003). Fibroblast biology in three-dimensional collagen matrices. Trends in Cell Biology, 13(5), 264-269.
- Bove, G. M., & Chapelle, S. L. (2012). Manual therapy as an effective treatment for fibrosis in a rat model of upper extremity musculoskeletal disorder. Journal of the Neurological Sciences, 312(1-2), 161-165.
- Schleip, R., & Müller, D. G. (2013). Training principles for fascial connective tissues: a new paradigm. Journal of bodywork and movement therapies, 17(1), 103-115.